Alchenele sunt hidrocarburile aciclice care con
Alchenele sunt hidrocarburile aciclice care con
ţin în molecula lor o legătură dublă între doi atomi de carbon. Alchenele au formula generală CnH2n, unde n reprezinta numărul de atomi de carbon din moleculă. Citiţi mai multe detalii în cele ce urmează.
Datorită prezenţei legăturii duble, alchenele fac parte din clasa hidrocarburilor nesaturate.
Dacă dăm valori lui n în formula generală a alchenelor, obţinem seria lor omoloagă. Compuşii se denumesc prin înlocuirea sufixului „an” de la alcani cu „enă”.Trebuie să remarcăm că seria alchenelor începe de la n=2.
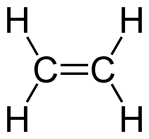
Exemplu: H2C═CH2 –– etenă
CH3─CH═CH2 ––- propenă
CH3─CH2─CH═CH2 ––- butenă, iar lista poate continua.
La alchenele cu mai mult de trei atomi de carbon, se denumeşte atomul purtător al dublei legături:
CH2═CH─CH2─CH3 (1- butena)
CH3─CH═CH─CH3 (2-butena)
La o catenă ramificată, se precizează atât poziţia dublei legături cât şi poziţia ramificaţiei, folosind indici numerici, alegându-se situaţia în care indicele care arată poziţia dublei legături să fie minim. Aveţi un exemplu în imaginea de mai jos:

Credit: Wikimedia CommonsÎn afară de izomeria de catenă, întâlnită la alcani, alchenele pot genera un nou tip de izomerie, denumită izomerie de poziţie. Cel mai întâlnit caz este 1-butena şi 2-butena.
Un alt tip de izomerie este izomeria geometrică ce se referă la poziţia substituenţilor faţă de legătura dublă C═C. De exemplu, 2-butena prezintă izomerii geometrici „cis” şi „trans”.

Credit: Wikimedia CommonsDe la alchene provin doi radicali importanţi ce intră în compoziţia unui număr mare de substanţe organice: vinil şi alil.

Credit: Wikimedia CommonsOBŢINEREA ALCHENELOR
a) Deshidratarea alcoolilor, prin încălzire cu acid sulfuric la 150 – 200°C.
R-CH2-CH2-OH (alcool) –> R-CH=CH2 (alchena) + H2O
b) Dehidrohalogenarea derivaţilor halogenaţi: La încălzire cu baze tari, în soluţii alcoolice, derivaţii halogenaţi elimină hidracid cu formarea unei alchene:
R-CH2-CH2X (derivat halogenat) –> R-CH=CH2 + HX , unde X poate fi F, Cl, Br sau I.
c) Cracarea alcanilor: În acest proces, larg aplicat în industrie, se formează cantităţi mari de alchene.
PROPRIETĂŢI FIZICE
Alchenele pot fi gazoase, lichide sau solide, după numărul atomilor de carbon din moleculă. Alchenele de la C2 la C5 sunt gaze, cele de la C5 la C18 sunt lichide, iar alchenele superioare sunt solide.
Punctele de fierbere şi de topire cresc o dată cu masa moleculară, dar sunt mai mici decât la alcanii corespunzători. Au densitatea mai mică decât apa, sunt insolubile în apă, dar solubile în solvenţi organici. Sunt incolore şi fără miros.
PROPRIETĂŢI CHIMICE
Datorită prezenţei dublei legături, reactivitatea chimică a alchenelor este mai mare decât a alcanilor.
I) Reacţii de adiţie
a) Adiţia hidrogenului:
R─CH═CH2 (alchenă) + H2 –> R─CH2─CH3 (alcan)
Procesul de hidrogenare la temperaturi cuprinse între 80 – 200°C şi până la 200 atm. Drept catalizatori se folosesc ca Ni, Pt, Pd, etc.
b) Adiţia halogenilor la alchene conduce la derivaţi di-halogenaţi vicinali (halogenul se leagă la atomi de carbon vecini).

Credit: Wikimedia Commons
c) Adiţia de hidracizi la alchene duce la obţinere de derivaţi mono-halogenaţi:
Atunci când alchena este simetrică, adiţia decurge fără condiţii, ca în exemplul de mai sus. Dacă alchena este asimetrică, atunci se aplică regula lui Markovnikov (atomul de halogen se fixează la atomul cel mai sărac în hidrogen).Exemplu:
R-CH=CH2 (alchenă asimetrică) + HCl –> R-CHCl-CH3 (derivat halogenat)
d) Adiţia apei la alchene duce la formarea alcoolilor (dacă avem o alchenă nesimetrică, se aplică regula lui Markovnikov). Reacţia este prezentată în imaginea de mai jos.

Credit: http://www.slcc-science.orgII) Reacţia de oxidare
Oxidarea cu permanganat de potasiu în mediu de acid sulfuric determină ruperea dublei legături cu obţinere de acizi sau cetone, în funcţie de structura alchenei supuse oxidării:






III) Reacţia de polimerizare
Prin polimerizare se înţelege procesul chimic prin care un mare număr de molecule identice, ale unor compuşi nesaturaţi, se leagă între ele, formând o moleculă unică (macromoleculă). Schematic, procesul de polimerizare se reprezintă:
nA → ─[A]n─
Exemplu: nCH2═CH2 → ─ [CH2─CH2]n ─ (polietenă)
Indicele n, numit grad de polimerizare, arată numărul de molecule de etenă care alcătuiesc lanţul macromolecular. Substanţa A este monomer, iar produsul final este polimerul.
Denumire
Denumirea alchenelor se face înlocuind sufixul „-an” (din denumirea alcanului cu număr identic de atomi de carbon) prin sufixul „-enă”. Cea mai simplă alchenă este etena C2H4, care poate fi scrisă și structural: H2C=CH2.
Există și alchene cu mai multe legături duble, așa numitele poliene.
Formula generală a acestora este CnH2n+2-2d, unde „d” reprezintă numărul de legături duble. Polienele se denumesc folosind gradul de multiplicitate al dublei legături. De exemplu poliena cu două legături duble se numește dienă (d=2), cu trei legături duble trienă ș.a.m.d.
Proprietati fizice
- Starea de agregare a alchenelor poate fi gazoasa, lichida sau solida în functie de masa lor molara.
- Punctele de fierbere ale alchenelor cresc, în general, cu cresterea masei molare si sunt comparabile cu ale alcanilor corespunzatori.
- Alchenele sunt insolubile în apa, dar se dizolva în solventi organici.
| ALCAN | p.f. ( ºC ) | ALCHENĂ | p.f. ( ºC ) |
| C2H6 | – 88,6 | C2H4 | – 103,9 |
| C3H8 | – 42,2 | C3H6 | – 47,7 |
| n- C4H10 | – 0,5 | CH2=CH-CH2-CH3 | – 6,5 |
Utilizari
Etena si propena sunt compusi organici produsi în cea mai mare cantitate pe plan mondial.
polimerizare
─ CH2 ─(CH2)n ─ CH2 ─ polietilena
+ H2O
CH3CH2OH OX.. CH3CHO OX.. CH3COOH
polimerizare
CH2=CH2 +Cl2 ClCH2CH2Cl –HCl CH2=CH─Cl PVC
+Cl2
HOCH2CH2Cl
+H2O
+HCl CH3CH2Cl
Actiunea biologica a alchenelor
- Etena este produsa de plante si stimuleaza coacerea fructelor, încoltirea semintelor si maturizarea florilor.
- În emanatia urât mirositoare a sconcsului apar doi derivati ai trans-2-butenei ce contin grupe mercaptanice (─ SH) sau de disulfura (─S─S─)
- Feromonii insectelor sunt compusi organici produsi de insecte în scopul comunicarii între ele. Numerosi feromoni sunt derivati ai olefinelor.